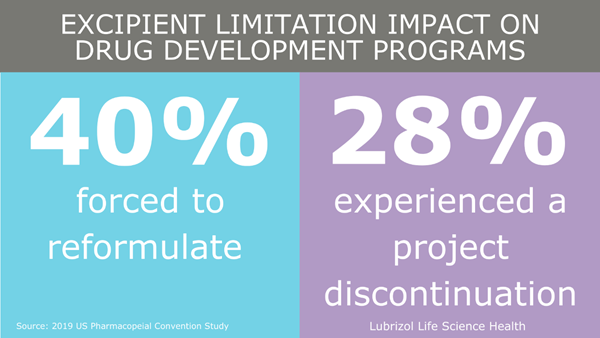
对于任何药品开发项目来说,要想获得成功,药物产品选用哪种辅料(非活性成分)、辅料是否合格——这两点非常重要。医疗辅料是已通过安全评估的非活性成分物质,可有意添加在药物递送系统中。要确保药品具有必需的特性,如更高的生物利用度或药物控释,辅料是不可或缺的。
但当前的法规管理情况,即辅料独立审批途径的缺乏,可能会钳制新辅料的市场准入,进而导致新药品上市受限。我们与路博润生命科学健康业务部(LLS)的法规管理战略和政策主任Meera Raghuram进行了座谈,讨论了新兴辅料的重要性,以及FDA近期采取的系列举措。
提问:什么是新兴辅料,辅料该如何获得批准?
“首先,人们通常认为,辅料需要通过“批准”——这是一种常见的误解。” Meera说,“实际上,FDA从来不会去批准非活性成分本身。在提交新药(NDA)、简易新药(ANDA)或505(b)(2)申请时,辅料是作为药物成品的组成成分之一接受审核的。这就为获批药物产品中的辅料使用设定了先例。因此,针对这一特定给药途径,在不超过每日允许最大摄入量的前提下,就不再有“新兴”辅料一说。”
新兴辅料一般是指之前从未在美国获批药物产品中使用过的非活性成分。但是,如果在特定给药途径中出现从未使用过的辅料,或辅料的用量高于已获批药物产品的先例,也可能被监管者视为“新兴”辅料。即便在其他获得FDA批准的、非医药应用中(例如食品和非处方药),一种辅料有广泛的应用,但如果用于药品,就属于“新兴”辅料,需要获得法规管理批准。FDA可能认定辅料可用的安全信息不足,拒绝批准,因此药品生产商一般不愿意在药品中使用新辅料。对于普通药品来说,审批的不确定性更高,因为这类药品的临床和非临床研究无需法规批准。
“当前暂时没有单独针对辅料的评估途径,因此,只有获批药品中含有辅料时,这种辅料才不再属于‘新兴’范畴,出现在FDA非活性成分数据库(IID)中。”Meera补充说。
问:什么是非活性成分数据库(IID)?
IID是一个重要的数据库,其中存储有辅料信息。药品开发者可以利用IID中的信息,评估可能在配方中使用的非活性成分。借助IID提供的信息,我们能了解特定给药途径的美国获批药物中,单位剂量辅料的最大效力。
“辅料只要进入数据库,就意味着有了使用先例,可在这种给药途径中安全使用。因此,下一次在类似药品中使用该辅料时,就不必再进行繁琐、严格的FDA审核。”Meera评论说,“自然,基于这一点考虑,药品开发商们常常倾向于只采用 列入IID的成分, 哪怕这种成分无法满足药品所有方面的最佳性能要求。”
问:只使用列入IID的辅料会有问题吗?
提问:FDA有何解决辅料问题的举措,制药行业在其中担任着怎样的角色?
“FDA与多个利益相关方进行了讨论,听取了他们表达的担忧,正在考虑开发新兴辅料毒理和质量评估试点项目,并就该项目寻求了利益相关方的反馈。这个项目基于自愿原则,每年可接收一定数量的申请进行审批。众多辅料供应商和使用方响应了FDA的试点项目,包括LLS健康部和相关行业协会等,都对该项目进行了评论。我们中绝大部分都支持这个项目, 这也证明了对此类新兴辅料项目的迫切需要。”
提问:新兴辅料审批项目可能带来哪些助益?
“此类项目可极大地推动新药品和治疗方法的开发,释放出之前被钳制的巨大潜力。如果在开发早期,这些重要的新辅料能获得法规方面的认可,就能鼓励更多人在配方设计和药物开发中考虑使用新辅料,为药物递送和生产方法创造更高的灵活性。”Meera说。
对于未来药品开发来说,新兴辅料审批项目裨益良多。我们总结了提交给FDA的反馈,项目潜力包括:
- 改善产品在稳定性、可溶性和递送方面的性能
- 降低整体开发成本,确保患者能以更低廉的价格、更快地用上新的治疗方法
- 延长药物释放时间,或实现更精准的药物递送,提高患者依从度
- 利用更多的产品组合,或为现有药物设计新剂型/给药途径时,拥有更多的配方选择
- 赋予药品新功能,防止患者滥用易上瘾药品,如鸦片类药物等
提问:LLS健康部在新兴辅料领域有何作为?
“LLS健康部能提供各类剂型的多种不同 辅料, 其中许多辅料已跻身IID,有获批药品应用先例。我们继续与客户合作,尽一切努力为市场提供最佳的治疗方法。我们工作的关键方面之一,是确保客户拥有合适的非活性成分选择,所以我们非常支持之前提到的FDA新项目。”Meera补充道。
LLS健康部的许多辅料尚未进入IID数据库,但拥有巨大潜力,能为配方提供许多重要助益,其中包括:
- 提高黏膜和生物膜粘附性
- 更好的药物控释和目标组织的药物渗透性
- 提高工艺灵活性,如使用聚合物实现更好的水中分散性,或选择能直接压制成片剂的聚合物(Carbopol® Ultrez 10和71G NF)
- 更好的流变控制和粘度调节,同时获得最优的外观和质感
作者:
Meera Raghuram | 法规管理战略和政策主任
Ashley M. Rein | 技术营销专家
参考文献: